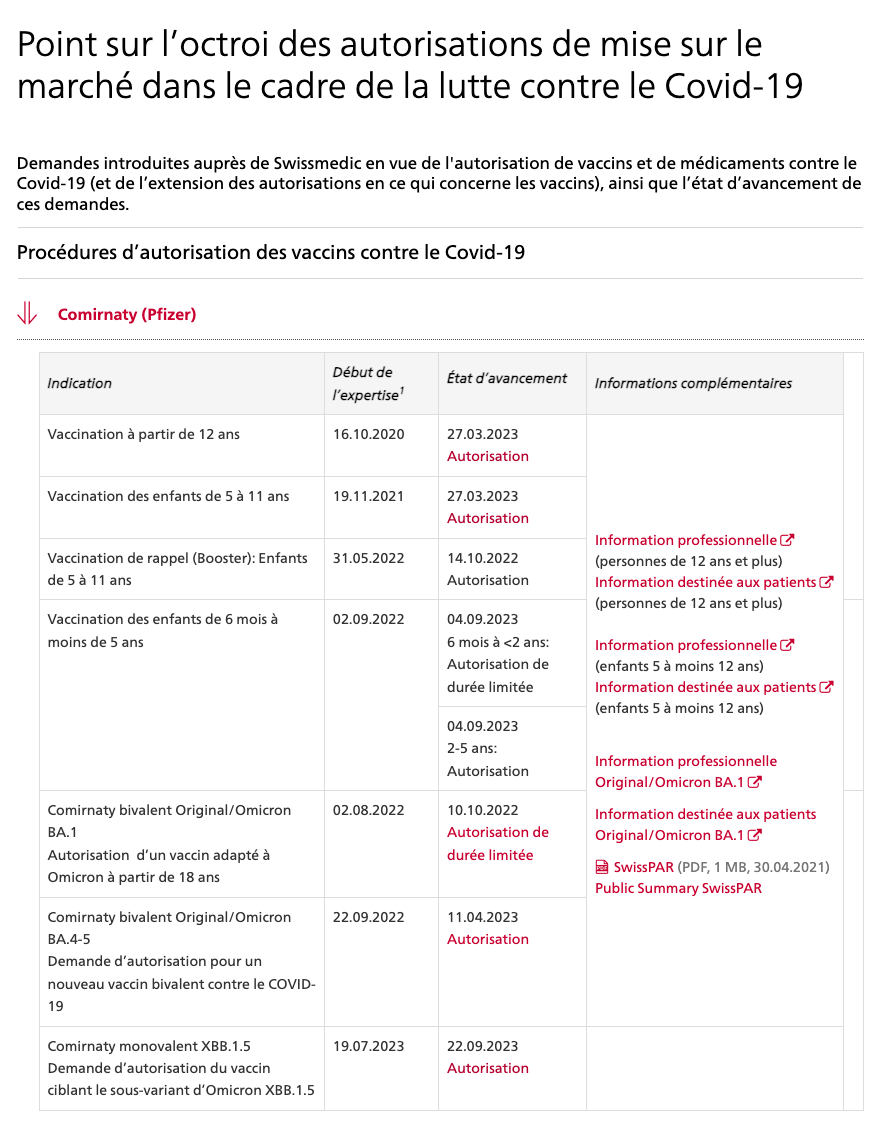
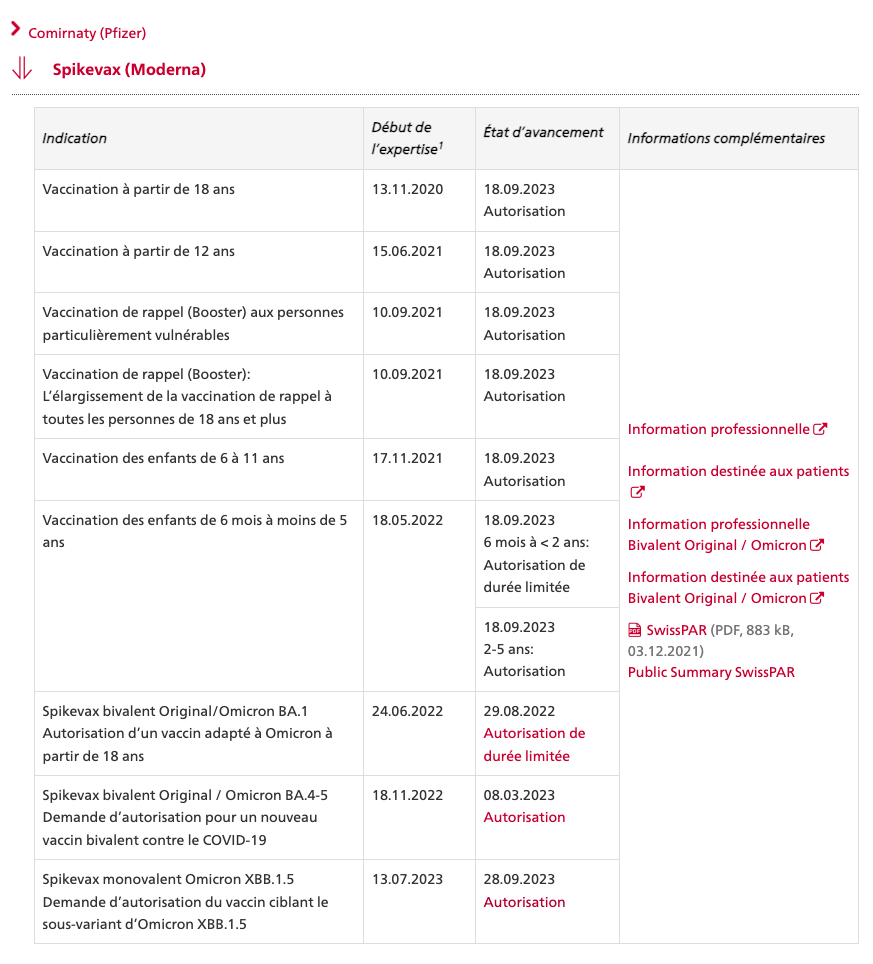
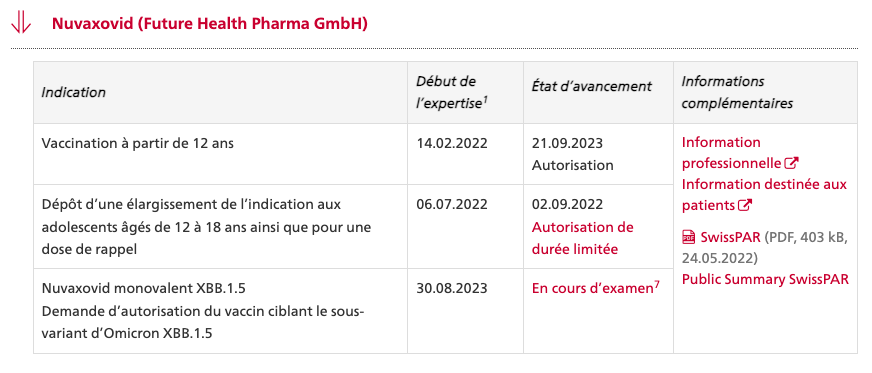
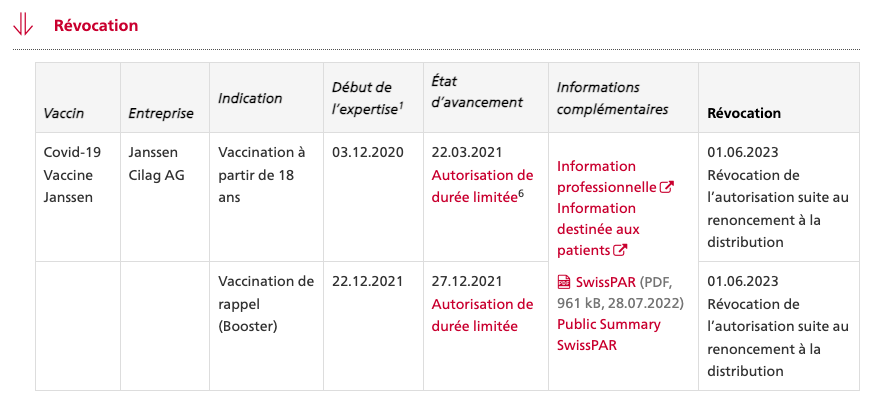
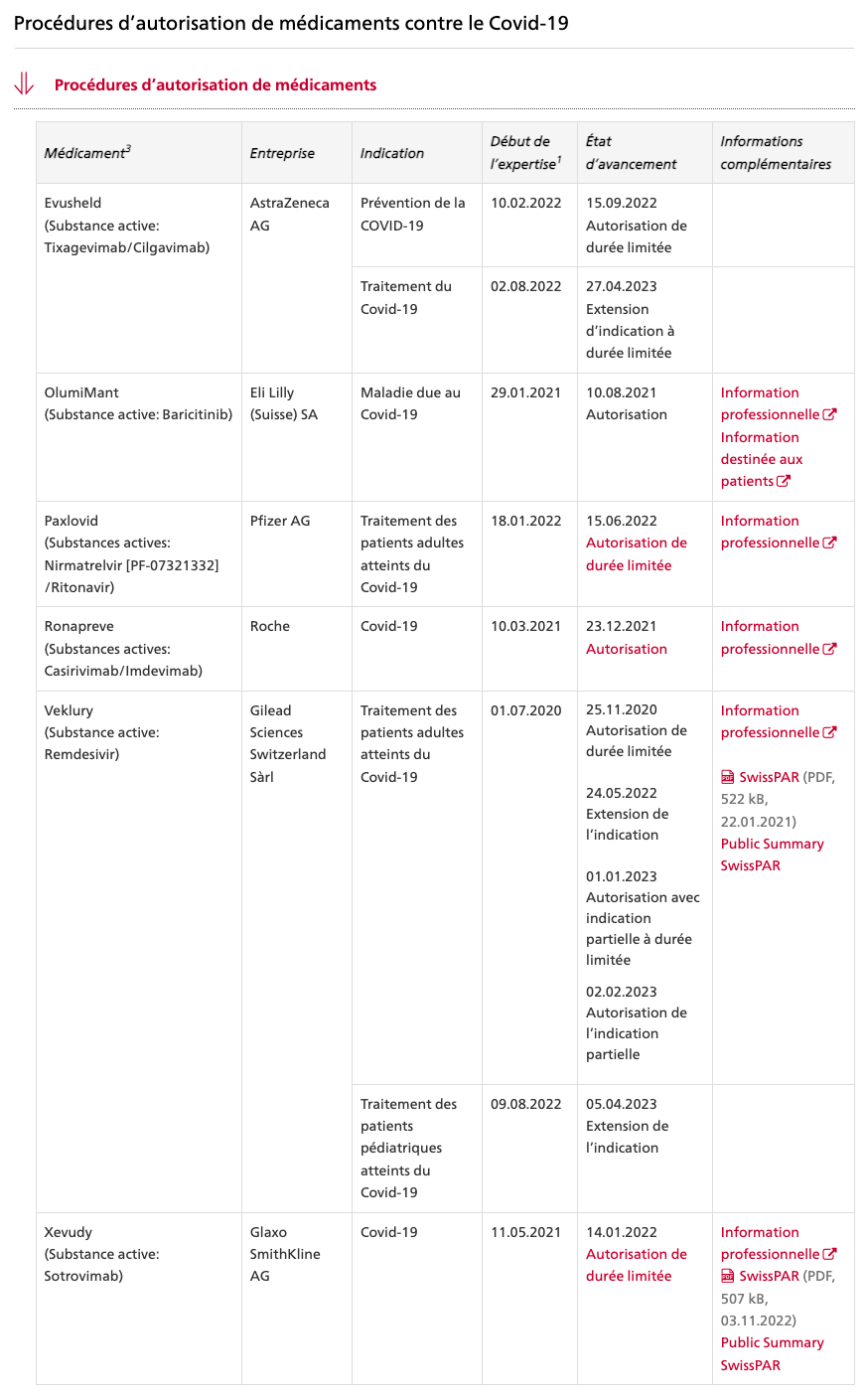
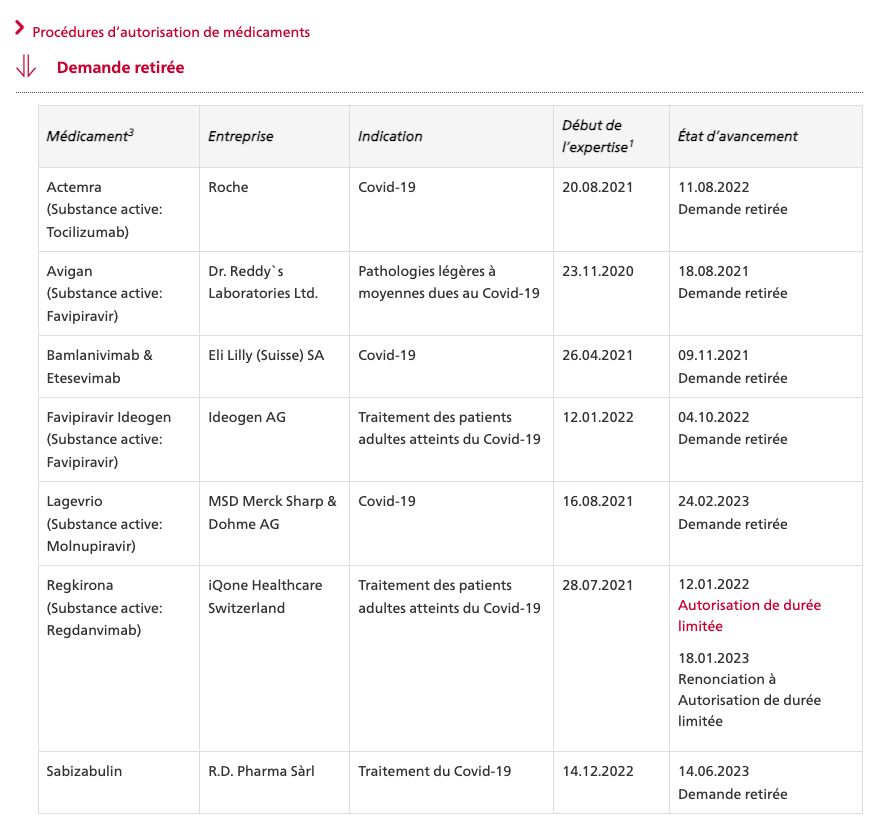
SPIKEVAX® bivalent original-omicron de Moderna mRNA 1273.214
dès 18 ans
Nouveaux principes actifs
Vaccin à ARNm (à nucléoside modifié : N1-methyl-pseudouridine)
50 mcg d’ARNm par dose.
Dose (0,5 ml) de la primovaccination contient 50 μg d’ARN messager (ARNm)
Une dose (0,5 ml) contient 25 µg d’élasoméran, un vaccin ARNm contre la COVID-19 (incorporé dans des nanoparticules lipidiques) et 25 µg d’imélasoméran, un vaccin ARNm contre la COVID-19 (incorporé dans des nanoparticules lipidiques).
L’imélasoméran est un ARN messager (ARNm) simple brin à coiffe en 5', codant la séquence entière d’une variante de conformation stabilisée avant fusion (K983P et V984P) et aux codons optimisés de la glycoprotéine de pointe (S) du SARS-CoV-2 (variant Omicron, B.1.1.529).
Excipients
Lipide SM-102
DSPC (1,2-distéaroyl-sn-glycéro-3-phosphocholine ,
PEG2000-DMG = 1,2-dimyristoyl-rac-glycéro-3-méthylpolyoxyéthyléne,
Trométamol : 0,31 mg
Chlorhydrate de trométamol : 1,18 mg
Acide acétique : 0,043 mg
Acétate de sodium trihydraté : 0,12 mg
Saccharose : 43,5 mg
Eau pour préparation injectables
Teneur totale en lipides : 1,93 mg
Quantité de sodium par dose de 0,5ml : 0,017 mg
Dispersion à diluer injectable (dispersion stérile), par voie intramusculaire.
Le vaccin est une dispersion congelée (pH: 7.0 à 8.0) de couleur blanche à blanc cassé.
Essais cliniques
https://clinicaltrials.gov/ct2/show/NCT05249829
A Phase 2/3, Randomized, Observer-blind, Active-controlled, Multicenter Study to Evaluate the Immunogenicity and Safety of Omicron Variant Vaccines in Comparison With mRNA-1273 (Prototype) Booster Vaccine
Start date: 16 February 2022
End date: 27 April 2023
https://clinicaltrials.gov/ct2/show/NCT05383560
Phase 2, Randomized, Observer-Blind, Investigator-Initiated, Collaborative Study to Evaluate the Safety and Immunogenicity of Omicron Variant-Matched Vaccine Booster in Adults
Start date: June 2022
End date: June 2023
https://clinicaltrials.gov/ct2/show/NCT05543356
A Randomised Controlled Trial to Assess the Immunogenicity, Safety and Reactogenicity of a Second Standard Monovalent (Ancestral) or Bivalent Omicron-specific COVID-19 Vaccine Booster Dose (Pfizer-BioNTech or Moderna) in Healthy Adults in Australia.
Start date: 10 October 2022
End date: 31 December 2023
Données précliniques
La cancérogénicité de Spikevax et son effet sur la fertilité masculine n’ont pas été évalués chez l’animal. Étant donné que le Spikevax s’administre à court terme, il n’est pas nécessaire d’effectuer des études à long terme chez l’animal afin d’en évaluer le potentiel cancérogène.
Toxicologie animale
L’administration intramusculaire de Spikevax (ou d’autres vaccins à ARNm expérimentaux de Moderna) au rat, à la même formulation, jusqu’à 4 doses de 9 à 150 μg toutes les 2 semaines, a entraîné des érythèmes et œdèmes transitoires au point d’injection, des augmentations de la température corporelle et une réponse inflammatoire systémique généralisée. Des modifications transitoires et réversibles des tests de laboratoire (dont des augmentations des éosinophiles, du temps de céphaline activée et du fibrinogène) ont été observées. Une vacuolisation transitoire des hépatocytes et/ou une hypertrophie des cellules de Kupffer ont été observées, souvent sans élévation des enzymes hépatiques, et sont considérées comme une conséquence de la réponse inflammatoire systémique. En général, tous ces changements se sont résolus dans les 2 semaines.
Mutagenèse
Le SM-102, un composant lipidique propriétaire de Spikevax, n’est pas génotoxique selon le test de mutagénicité bactérienne et l’essai d’aberration chromosomique des lymphocytes du sang périphérique humain. Deux tests de micronoyau in vivo intraveineux ont été effectués avec des thérapies à ARNm en utilisant la même formulation à nanoparticules lipidiques (NPL) que le Spikevax. Les résultats équivoques observés à des concentrations systémiques élevées sont probablement dus à la formation de micronoyaux suite à une température corporelle élevée causée par la réponse inflammatoire systémique provoquée par les NPL. Le risque génotoxique pour les humains est considéré comme faible en raison de l’exposition systémique minimale suivant l’administration intramusculaire, la durée limitée de l’exposition et les résultats in vitro négatifs.
Toxicité sur la reproduction
Dans une étude de toxicité développementale, 0,2 ml d’une formulation vaccinale contenant la même quantité d’ARNm (100 microgrammes) et d’autres ingrédients inclus dans une dose unique de Spikevax chez l’homme a été administré à des rates, par voie intramusculaire, à quatre reprises: 28 et 14 jours avant l’accouplement, et aux jours 1 et 13 de gestation. Des réponses des anticorps anti-SARS-CoV-2 ont été observées chez les mères avant l’accouplement jusqu’à la fin de l’étude au jour 21 de l’allaitement, ainsi que chez les fœtus et la progéniture. Il n’y a eu aucun effet indésirable sur la fertilité des rates, la gestation, le développement embryo-fœtal ou postnatal de la progéniture. Aucune donnée n’est disponible sur le transfert placentaire ou l’excrétion dans le lait du vaccin mRNA1273.
Données pharmacologiques et d’efficacité chez l’animal
Des évaluations de pharmacologie non cliniques en modèle animal ont été effectuées sur des souris de type sauvage juvéniles et adultes (souches Balb/c, C57/BL6 et C4B6), des hamsters dorés et des primates non humains (macaques rhésus, PNH) afin de tester l’immunogénicité de Spikevax et la protection contre la provocation virale du SARS-CoV-2. Ces études précliniques ont démontré que le Spikevax était toléré et immunogène, qu’il protégeait les animaux vaccinés contre la réplication virale dans le nez et les voies respiratoires inférieures après provocation virale, à des doses aussi faibles que 1 μg chez les souris et les hamsters et 30 μg chez les PNH, et qu’il n’a pas induit de maladie respiratoire aggravée (MRA) à des posologies protectrices ou sous-protectrices chez ces modèles animaux. En outre, des réponses des lymphocytes T CD4 Th1 ont été mesurées chez toutes les espèces animales et une réponse CD8 solide a été mesurée chez la souris.